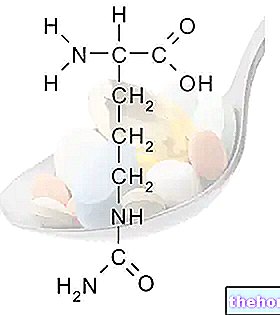
Активные ингредиенты: капецитабин.
Кселода 150 мг таблетки, покрытые пленочной оболочкой
Пакеты-вкладыши Xeloda доступны для размеров упаковки:- Кселода 150 мг таблетки, покрытые пленочной оболочкой
- Кселода 500 мг таблетки, покрытые пленочной оболочкой
Почему используется Кселода? Для чего это?
Кселода принадлежит к группе лекарств, называемых «цитостатическими лекарствами», которые останавливают рост раковых клеток. Кселода содержит 150 мг капецитабина, который сам по себе не является цитостатическим лекарством. Только после того, как он всасывается в организм, он превращается в активное противораковое лекарство (в большей степени в опухолевых тканях, чем в нормальных тканях).
Кселода назначается врачами для лечения рака толстой и прямой кишки, желудка или груди. Также Кселода назначается для предотвращения появления нового рака толстой кишки после полного хирургического удаления опухоли.
Кселоду можно использовать отдельно или в сочетании с другими лекарствами.
Противопоказания Когда нельзя применять Кселоду
Не принимайте Кселоду:
- если у вас аллергия на капецитабин или какие-либо другие ингредиенты этого лекарства (перечислены в разделе 6). Вы должны сообщить своему врачу, если знаете, что у вас аллергия или у вас чрезмерная реакция на это лекарство.
- если у вас ранее была серьезная реакция на терапию фторпиримидином (группа противоопухолевых препаратов, таких как фторурацил),
- если вы беременны или кормите грудью,
- если у вас слишком низкий уровень лейкоцитов и тромбоцитов в крови (лейкопения, нейтропения или тромбоцитопения),
- если у вас серьезные проблемы с печенью или почками,
- если у вас есть известный дефицит фермента дигидропиримидиндегидрогеназы (DPD), участвующего в метаболизме урацила и тимина, или
- если вы в настоящее время лечитесь или лечились в течение последних 4 недель бривудином, соривудином или веществами аналогичного класса в рамках терапии опоясывающего герпеса (ветряная оспа или огонь Святого Антония).
Меры предосторожности при использовании Что нужно знать перед приемом Кселоды
Перед приемом Кселоды посоветуйтесь со своим врачом или фармацевтом:
- если у вас заболевание почек или печени,
- если у вас были или есть проблемы с сердцем (например, нерегулярная частота сердечных сокращений или боли, иррадиирующие от груди к челюсти и наоборот, вызванные физическими нагрузками и проблемами с притоком крови к сердцу),
- если у вас есть заболевание головного мозга (например, опухоль, распространившаяся на мозг) или повреждение нервов (невропатия),
- если у вас есть дисбаланс уровня кальция (что можно увидеть в анализах крови),
- если у вас диабет,
- если вы не можете удерживать пищу или воду в своем теле из-за сильной тошноты и рвоты,
- если вы страдаете диареей,
- если вы страдаете или можете стать обезвоженным,
- если у вас есть ионный дисбаланс в крови (электролитный дисбаланс, который можно найти в анализах крови),
- если у вас проблемы со зрением, поскольку вам может потребоваться дополнительное наблюдение за глазами.
- если у вас сильная кожная реакция.
Дефицит дигидропиримидиндегидрогеназы (DPD): дефицит DPD - это редкое заболевание, присутствующее при рождении, которое обычно не связано с проблемами со здоровьем, если не принимаются определенные лекарства. Если у вас неизвестный дефицит DPD и вы принимаете Кселоду, побочные эффекты, перечисленные в разделе 4 «Возможные побочные эффекты», могут проявляться в тяжелой форме. Сообщите своему врачу, если вас беспокоят какие-либо побочные эффекты или вы заметите какие-либо побочные эффекты, не указанные в данном информационном листке (см. Раздел 4 «Возможные побочные эффекты»).
Дети и подростки
Кселода не назначается для лечения детей и подростков. Не давайте Кселоду детям и подросткам.
Взаимодействие Какие лекарства или продукты могут изменить действие Кселоды
Другие лекарственные препараты и Кселода
Перед началом лечения сообщите своему врачу или фармацевту, если вы принимаете, недавно принимали или собираетесь принимать какие-либо другие лекарства. Это имеет принципиальное значение, поскольку одновременный прием нескольких лекарственных средств может усилить или уменьшить их действие.Особое внимание следует уделять при одновременном приеме:
- лекарства от подагры (аллопуринол),
- лекарства, разжижающие кровь (кумарин, варфарин),
- некоторые противовирусные препараты (соривудин и бривудин),
- лекарства для лечения судорог или тремора (фенитоин),
- интерферон альфа,
- лучевая терапия и некоторые лекарства, используемые для лечения рака (фолиевая кислота, оксалиплатин, бевацизумаб, цисплатин, иринотекан),
- лекарства, используемые для лечения дефицита фолиевой кислоты.
Кселода с едой и питьем
Вы должны принять Кселоду в течение 30 минут после окончания еды.
Предупреждения Важно знать, что:
Беременность и кормление грудью
Перед началом лечения сообщите своему врачу, если вы беременны, подозреваете или планируете забеременеть. Вы не должны принимать Кселоду, если вы беременны или подозреваете беременность. Вы не должны кормить грудью, принимая Кселоду. Прежде чем принимать это лекарство, посоветуйтесь со своим врачом или фармацевтом.
Вождение и использование машин
Кселода может вызвать у вас головокружение, тошноту или усталость. Поэтому возможно, что Xeloda может повлиять на способность управлять автомобилем или работать с механизмами.
Кселода содержит безводную лактозу.
Если врач сказал вам, что у вас «непереносимость некоторых сахаров», обратитесь к врачу, прежде чем принимать это лекарство.
Доза, способ и время приема Как применять Кселоду: Дозировка
Всегда принимайте это лекарство в точном соответствии с указаниями врача или фармацевта. Если вы не уверены, проконсультируйтесь с врачом или фармацевтом.
Кселоду должен назначать только врач, специализирующийся на применении противоопухолевых препаратов.
Таблетки Кселоды следует проглатывать целиком, запивая водой в течение 30 минут после окончания еды.
Ваш врач назначит вам подходящую дозировку и схему лечения. Дозировка Кселоды зависит от площади поверхности тела. Это рассчитывается исходя из роста и веса. Обычная доза для взрослых составляет 1250 мг / м2 площади поверхности тела два раза в день (утром и вечером). Предлагаются два примера: человек с массой тела 64 кг и ростом 1,64 м имеет площадь поверхности тела 1,7 м2 и необходимо принимать 4 таблетки по 500 мг и 1 таблетку по 150 мг два раза в день. Человек с массой тела 80 кг и ростом 1,80 м имеет площадь поверхности тела 2,00 м2 и должен принимать по 5 таблеток по 500 мг два раза в день.
Таблетки Кселоды обычно принимают в течение 14 дней, после чего следует 7-дневный период отдыха (в течение которого таблетки не принимаются). Эти 21 день соответствуют циклу терапии.
В сочетании с другими лекарствами обычная доза для взрослых может составлять менее 1250 мг / м2 площади поверхности тела, и таблетки, возможно, необходимо принимать в течение другого периода времени (например, каждый день, без периода отдыха).
Ваш врач скажет вам, какую дозу вам нужно принять, когда ее принимать и как долго вам нужно ее принимать.
Ваш врач может назначить комбинацию таблеток 150 мг и 500 мг для каждой дозы.
- Принимайте таблетки утром и вечером по назначению врача.
- Принимайте таблетки в течение 30 минут после окончания еды (завтрак и ужин).
- Важно принимать все лекарства, назначенные врачом.
Передозировка Что делать, если вы приняли слишком много Кселоды
Если вы приняли больше Кселоды, чем предусмотрено
Если вы приняли больше Кселоды, чем предусмотрено, как можно скорее обратитесь к врачу, прежде чем принимать следующую дозу.
Если вы приняли больше Кселоды, чем предусмотрено, у вас могут возникнуть следующие побочные эффекты: тошнота или рвота, диарея, воспаление или изъязвление кишечника или рта, боль или кровотечение из кишечника или желудка или угнетение костного мозга (уменьшение определенного тип клеток крови). Если у вас появятся какие-либо из этих симптомов, немедленно обратитесь к врачу.
Если вы забыли принять Кселоду:
Не принимайте пропущенную дозу и не увеличивайте вдвое следующую. Вместо этого продолжайте принимать обычную дозировку и обратитесь к врачу.
Если вы перестанете принимать Кселоду:
Прекращение лечения капецитабином не вызывает побочных эффектов. Прекращение приема капецитабина, если вы принимаете антикоагулянты кумарина (например, содержащие фенпрокумон), может потребовать от врача изменить дозу антикоагулянта.
Если у вас есть дополнительные вопросы по использованию этого продукта, спросите своего врача или фармацевта.
Побочные эффекты Каковы побочные эффекты Кселоды
Как и все лекарства, это лекарство может вызывать побочные эффекты, хотя они возникают не у всех.
Немедленно прекратите прием Кселоды и обратитесь к врачу при развитии любого из следующих симптомов:
- Диарея: если у вас наблюдается учащение испражнений на 4 или более в день по сравнению с обычным испражнением или ночная диарея.
- Рвота: если вас рвет чаще, чем один раз в сутки.
- Тошнота: если вы теряете аппетит и количество пищи, потребляемой за день, намного меньше обычного.
- Стоматит: если у вас есть боль, покраснение, отек или язвы во рту или горле.
- Кожная реакция рук и ног: если у вас есть боль, отек, покраснение или покалывание в руках и / или ногах.
- Лихорадка: если у вас температура тела 38 ° C и выше.
- Инфекция: если у вас есть признаки заражения бактериями, вирусами или другими организмами.
- Боль в груди: если вы испытываете боль, локализованную в центре груди, особенно если она возникает во время упражнений.
- Синдром Стивена-Джонсона: если у вас появляется болезненная красная или пурпурная сыпь, которая распространяется и появляются волдыри и / или другие поражения, которые начинают появляться на слизистой оболочке (например, во рту и губах), особенно если у вас ранее была светочувствительность, инфекции дыхательная система (например, бронхит) и / или лихорадка.
При раннем выявлении эти побочные эффекты обычно проходят в течение 2-3 дней после прекращения приема лекарства. Если симптомы не исчезнут, немедленно обратитесь к врачу. Ваш врач может посоветовать вам возобновить прием лекарства в более низкой дозе.
В дополнение к перечисленным выше, другие очень распространенные побочные эффекты, о которых сообщалось при использовании одной Кселоды, которые могут затронуть более 1 человека из 10, включают:
- боль в животе
- сыпь, сухость или зуд кожи
- усталость
- потеря аппетита (анорексия).
Эти побочные эффекты могут стать серьезными. Поэтому всегда немедленно обращайтесь к врачу, если заметите побочный эффект. Ваш врач посоветует вам уменьшить дозу и / или временно прекратить лечение Кселодой. Это поможет снизить вероятность того, что побочный эффект сохранится или превратится в серьезный побочный эффект.
Другие побочные эффекты:
Общие побочные эффекты (им могут быть подвержены до 1 человека из 10) включают:
- уменьшение количества лейкоцитов или эритроцитов в крови (видно в тестах),
- обезвоживание, похудание,
- недосыпание (бессонница), депрессия,
- головная боль, сонливость, головокружение, ненормальное ощущение кожи (онемение или покалывание), изменение вкуса,
- раздражение глаз, повышенное слезотечение, красные глаза (конъюнктивит),
- воспаление вен (тромбофлебит),
- одышка, кровотечение из носа, кашель, насморк,
- герпес или другие инфекции герпеса,
- инфекции легких или дыхательной системы (например, пневмония или бронхит),
- кишечное кровотечение, запор, боль в верхней части живота, несварение желудка, избыток воздуха, сухость во рту,
- кожная сыпь, выпадение волос (алопеция), покраснение кожи, сухость кожи, зуд, изменение цвета кожи, потеря кожи, воспаление кожи, изменения ногтей,
- боль в суставах или конечностях (конечностях), груди или спине,
- лихорадка, отек конечностей, плохое самочувствие,
- проблемы с функцией печени (обнаруживаются в анализах крови) и повышенный уровень билирубина в крови (выводится через печень).
Необычные побочные эффекты (им подвержены менее 1 человека из 100) включают:
- инфекция крови, инфекция мочевыводящих путей, кожная инфекция, инфекция носа и горла, грибковые инфекции (в том числе инфекции полости рта), грипп, гастроэнтерит, абсцесс,
- мягкие припухлости под кожей (липома),
- уменьшение количества клеток крови, включая тромбоциты, разжижение крови (видно в тестах),
- аллергия,
- диабет, снижение калия в крови, недоедание, повышение уровня триглицеридов в крови,
- спутанность сознания, панические атаки, подавленное настроение, снижение либидо,
- трудности с речью, нарушение памяти, потеря координации движений, нарушение равновесия, обмороки, повреждение нервов (невропатия) и проблемы с чувствами,
- помутнение или двоение в глазах,
- головокружение, боль в ушах,
- нерегулярное сердцебиение и сердцебиение (аритмия), боль в груди и сердечный приступ (сердечный приступ),
- сгустки крови в глубоких венах, повышенное или пониженное артериальное давление, гиперемия, холод в конечностях (конечностях), пурпурные пятна на коже,
- тромбы в венах легкого (тромбоэмболия легочной артерии), коллапс легкого, кровопотеря при кашле, астма, одышка при физической нагрузке,
- непроходимость кишечника, скопление жидкости в брюшной полости, воспаление тонкой или толстой кишки, желудка или пищевода, боль внизу живота, дискомфорт в животе, изжога (отток пищи из желудка), кровь в стуле,
- желтуха (пожелтение кожи и глаз),
- кожные язвы и волдыри, кожные реакции на солнечный свет, покраснение ладоней, отек или боль лица,
- отек или жесткость суставов, боль в костях, мышечная слабость или жесткость,
- скопление жидкости в почках, учащенное мочеиспускание в ночное время, недержание мочи, кровь в моче, повышение креатинина в крови (признак дисфункции почек),
- необычное кровотечение из влагалища,
- припухлость (отек), озноб и скованность.
Некоторые из этих побочных эффектов распространены, когда капецитабин используется с другими лекарствами для лечения рака. В этом контексте наблюдаются и другие побочные эффекты:
Общие побочные эффекты (им могут быть подвержены до 1 человека из 10) включают:
- снижение натрия, магния и кальция в крови, повышение сахара в крови,
- невралгия,
- звон в ушах (тиннитус), потеря слуха,
- воспаление вен,
- икота, измененный голос,
- боль или измененное / ненормальное ощущение во рту, боль в челюсти,
- потливость, ночная потливость,
- мышечные спазмы,
- затрудненное мочеиспускание, кровь или белок в моче,
- синяки или реакции в месте инъекции (вызванные лекарствами, вводимыми в одно и то же время).
Редкие побочные эффекты (им могут быть подвержены до 1 человека из 1000) включают:
- сужение или закупорка слезного протока (стеноз слезного протока),
- печеночная недостаточность,
- воспаление, приводящее к дисфункции или блокированию секреции желчи (холестатический гепатит),
- специфические изменения электрокардиограммы (удлинение интервала QT),
- определенные типы аритмий (включая фибрилляцию желудочков, пуантах де трепанации и брадикардию),
- воспаление глаз, вызывающее боль и потенциальные проблемы со зрением,
- воспаление кожи, приводящее к появлению красных пятен и шелушению из-за болезни иммунной системы.
Очень редкие побочные эффекты (им могут быть подвержены до 1 человека из 10 000) включают:
- серьезные кожные реакции, такие как сыпь, изъязвление и образование волдырей, которые могут включать язвы во рту, носу, гениталиях, руках, ногах и глазах (красные и опухшие глаза).
Сообщение о побочных эффектах
Если у вас появятся какие-либо побочные эффекты, поговорите со своим врачом, фармацевтом или медсестрой. Это включает в себя любые возможные побочные эффекты, не перечисленные в этой брошюре. Вы также можете сообщить о побочных эффектах напрямую через национальную систему отчетности, перечисленную в Приложении V. Побочные эффекты, которым вы можете помочь предоставьте дополнительную информацию о безопасности этого лекарства.
Срок действия и удержание
Хранить в недоступном для детей месте.
Не хранить при температуре выше 30 ° C.
Не используйте это лекарство после истечения срока годности, указанного на внешней упаковке и на этикетке после «EXP». Срок годности относится к последнему дню месяца.
Лекарства нельзя выбрасывать в канализацию или бытовые отходы. Узнайте у фармацевта, как утилизировать лекарства, которые вы больше не используете. Это поможет защитить окружающую среду.
Состав и лекарственная форма
Что содержит Кселода
Действующее вещество - капецитабин (150 мг на каждую таблетку, покрытую пленочной оболочкой).
Другие вспомогательные вещества:
- Ядро таблетки: безводная лактоза, кроскармеллоза натрия, гипромеллоза, микрокристаллическая целлюлоза, стеарат магния.
- Покрытие таблеток: гипромеллоза, диоксид титана (E171), желтый и красный оксид железа (E172), тальк.
Как выглядит Кселода и что содержится в упаковке
Таблетка светло-персикового цвета, двояковыпуклая, продолговатой формы, покрытая пленочной оболочкой, с тиснением «150» с одной стороны и «Xeloda» с другой стороны.
Упаковка таблеток Кселода 150 мг, покрытых пленочной оболочкой, содержит 60 таблеток, покрытых пленочной оболочкой (6 блистеров по 10 таблеток).
Листовка с исходным кодом: AIFA (Итальянское агентство по лекарственным средствам). Контент опубликован в январе 2016 года. Представленная информация может быть устаревшей.
Чтобы иметь доступ к самой последней версии, рекомендуется зайти на сайт AIFA (Итальянское агентство по лекарственным средствам). Заявление об ограничении ответственности и полезная информация.
01.0 НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
XELODA 150 MG ТАБЛЕТКИ, ПОКРЫТЫЕ ПЛЕНКОЙ
02.0 КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ
Каждая таблетка, покрытая пленочной оболочкой, содержит 150 мг капецитабина.
Наполнитель (ы) с известным эффектом:
каждая таблетка с пленочным покрытием содержит 15,6 мг безводной лактозы.
Полный список вспомогательных веществ см. В разделе 6.1.
03.0 ФАРМАЦЕВТИЧЕСКАЯ ФОРМА
Таблетка, покрытая пленочной оболочкой.
Таблетки Кселода 150 мг, покрытые пленочной оболочкой, представляют собой таблетки светло-персикового цвета, двояковыпуклые, продолговатой формы, с тиснением «150» на одной стороне и «Кселода» на другой стороне.
04.0 КЛИНИЧЕСКАЯ ИНФОРМАЦИЯ
04.1 Терапевтические показания
Кселода показана в качестве адъювантной терапии у пациентов, перенесших операцию по поводу рака толстой кишки III стадии (Dukes C) (см. Раздел 5.1).
Кселода показана для лечения метастатического колоректального рака (см. Раздел 5.1).
Кселода показана в качестве первой линии лечения распространенного рака желудка в сочетании с режимом на основе платины (см. Раздел 5.1).
Кселода в комбинации с доцетакселом (см. Раздел 5.1) показана для лечения пациентов с местнораспространенным или метастатическим раком молочной железы после неэффективности цитотоксической химиотерапии. Предыдущая терапия должна была включать «антрациклин. Кроме того, Кселода показана в качестве монотерапии для лечения пациентов с местнораспространенным или метастатическим раком молочной железы после неэффективности режима химиотерапии таксаном и антрациклином, содержащим химиотерапию, или которым антрациклин не показан». дальнейшая антрациклиновая терапия.
04.2 Дозировка и способ применения
Кселоду должен назначать только врач, специализирующийся на применении противоопухолевых препаратов.В течение первого курса лечения всем пациентам рекомендуется тщательное наблюдение.
Лечение следует прекратить при возникновении тяжелой токсичности или прогрессирования заболевания. Расчеты стандартной и уменьшенной доз на основе площади поверхности тела для начальных доз Кселоды 1250 мг / м2 и 1000 мг / м2 подробно представлены в таблицах 1 и 2, соответственно.
Дозировка
Рекомендуемая дозировка (см. Раздел 5.1):
Монотерапия
Рак толстой кишки, толстой кишки и груди
При монотерапии рекомендуемая начальная доза капецитабина для адъювантного лечения толстой кишки, метастатического колоректального или местно-распространенного или метастатического рака молочной железы составляет 1250 мг / м2, вводимая два раза в день (утром и вечером; общая суточная равна 2500 мг / м2). в течение 14 дней с последующим 7-дневным периодом отдыха. Адъювантная терапия у пациентов с раком толстой кишки III стадии рекомендуется в течение 6 месяцев.
Ассоциативная терапия
Рак толстой кишки, толстой кишки и желудка
При комбинированном лечении рекомендуемая начальная доза капецитабина должна быть снижена до 800 - 1000 мг / м2 при приеме дважды в день в течение 14 дней с последующим 7-дневным периодом отдыха или до 625 мг / м2 два раза в день при непрерывном введении (см. Раздел 5.1). В комбинации с иринотеканом рекомендуемая начальная доза составляет 800 мг / м2 при приеме дважды в день в течение 14 дней с последующим 7-дневным периодом отдыха в комбинации с иринотеканом 200 мг / м2 в день 1. Введение бевацизумаба в комбинированной схеме. не влияет на начальную дозу капецитабина. У пациентов, получавших комбинацию капецитабина и цисплатина, премедикация для поддержания адекватной гидратации и противорвотное лечение следует начинать до введения цисплатина, в соответствии с Резюме характеристик продукта цисплатина. Премедикация противорвотными средствами рекомендуется пациентам, принимающим комбинацию капецитабина и оксалиплатина, в соответствии с Кратким описанием характеристик оксалиплатина. Рекомендуется 6-месячный курс адъювантного лечения пациентам с раком толстой кишки III стадии.
Рак молочной железы
В комбинации с доцетакселом рекомендуемая начальная доза капецитабина при лечении метастатического рака молочной железы составляет 1250 мг / м2 два раза в день в течение 14 дней с последующим 7-дневным периодом отдыха в комбинации с доцетакселом 75 мг / м2 внутривенно через 1 час. настой каждые 3 недели. У пациентов, получающих комбинацию капецитабина и доцетаксела, премедикацию пероральными кортикостероидами, такими как дексаметазон, следует начинать до введения доцетаксела в соответствии с Кратким описанием характеристик продукта доцетаксела.
Расчет дозы Кселоды
Таблица 1 Расчет стандартной и сниженной доз капецитабина на основе площади поверхности тела, начальная доза 1250 мг / м2
Таблица 2 Расчет стандартной и сниженной доз капецитабина на основе площади поверхности тела, начальная доза 1000 мг / м2
Корректировка дозировки во время лечения:
Общий
Токсичность, вызванная введением капецитабина, можно контролировать с помощью симптоматического лечения и / или изменения дозы (прерывание лечения или снижение дозы). После снижения дозы ее не следует увеличивать. В случае токсичности, которая, по мнению лечащего врача, вряд ли может стать серьезной или смертельной, например, облысение, изменение вкуса, изменения ногтей, лечение можно продолжить в той же дозе без уменьшения или прерывания. Пациентам, принимающим капецитабин, следует предупредить о необходимости немедленно прекратить лечение при возникновении умеренной или тяжелой токсичности. Дозы капецитабина, исключенные из-за токсичности, не подлежат замене. Ниже приведены рекомендуемые изменения дозы в случае токсичности:
Таблица 3 График снижения дозы капецитабина (3-недельный цикл или непрерывное лечение)
* В соответствии с Общими критериями токсичности (версия 1) Группы клинических испытаний Национального института рака Канады (NCIC CGT) или Общими критериями терминологии для нежелательных явлений (CTCAE) Программы оценки терапии рака Национального института рака США, версия 4.0 . Информацию о синдроме кистей и стоп и гипербилирубинемии см. В разделе 4.4.
Гематология
Пациенты с исходным уровнем нейтрофилов
Изменение дозы в связи с токсичностью при применении капецитабина в виде трехнедельного цикла в сочетании с другими лекарственными средствами.
Когда капецитабин используется в 3-недельных циклах в сочетании с другими лекарственными средствами, необходимо изменить дозу с учетом токсичности в соответствии с таблицей 3 выше для капецитабина и в соответствии с соответствующим кратким обзором характеристик продукта для другого лекарственного средства (-ов). .
Если в начале цикла лечения показана отсрочка лечения для капецитабина или другого лекарственного средства (-ов), прием всех лекарственных средств следует отложить до тех пор, пока не появятся требования о возобновлении приема всех лекарственных средств.
Во время курса лечения, если лечащий врач считает, что токсичность не связана с капецитабином, лечение капецитабином следует продолжить, а дозу другого лекарственного средства следует скорректировать в соответствии с соответствующей информацией о назначении.
Если прием других лекарственных средств будет окончательно прекращен, лечение капецитабином можно возобновить, как только будут выполнены требования для повторного введения капецитабина.
Этот подход применим ко всем показаниям и ко всем особым группам пациентов.
Изменение дозы в связи с токсичностью при непрерывном применении капецитабина в сочетании с другими лекарственными средствами.
Модификации доз для токсичности, когда капецитабин используется в качестве непрерывного лечения в сочетании с другими лекарственными средствами, следует проводить в соответствии с Таблицей 3 выше для капецитабина и в соответствии с соответствующими Краткими характеристиками продукта для другого лекарственного препарата (ов).
Корректировка дозировки для конкретных групп пациентов:
Нарушение функции печени
Данных о безопасности и эффективности недостаточно, чтобы дать рекомендации по корректировке доз для пациентов с нарушением функции печени. Нет данных о печеночной недостаточности вследствие цирроза или гепатита.
Нарушение функции почек
Капецитабин противопоказан пациентам с тяжелой почечной недостаточностью (исходный клиренс креатинина менее 30 мл / мин [Кокрофт и Голт]). Частота побочных реакций 3 или 4 степени у пациентов с умеренной почечной недостаточностью (исходный клиренс креатинина 30-50 мл / мин) выше, чем в общей популяции. Рекомендуется снижение на 75% для начальной дозы 1250 мг / м2. у пациентов с умеренной почечной недостаточностью на исходном уровне. У пациентов с умеренной почечной недостаточностью на исходном уровне снижение дозы не требуется для начальной дозы 1000 мг / м2. Если во время лечения у пациента развиваются нежелательные явления 2, 3 или 4 степени, необходимо провести тщательный мониторинг и «Немедленное прекращение лечения и следующую дозу следует скорректировать, как указано в таблице 3 выше. Если расчетный клиренс креатинина падает во время лечения. При менее 30 мл / мин прием Кселоды следует прекратить. Эти рекомендации по корректировке доз при почечной недостаточности применимы как к монотерапии, так и к комбинированному применению (см. Также раздел «Пожилые люди» ниже).
Пожилые граждане
При использовании только капецитабина не требуется коррекции начальной дозы, однако пациенты в возрасте ≥ 60 лет по сравнению с более молодыми людьми чаще сообщали о побочных реакциях 3 или 4 степени, связанных с лечением.
Когда капецитабин применялся в комбинации с другими агентами, у пожилых пациентов (≥ 65 лет) было больше побочных реакций 3 и 4 степени, включая те, которые приводили к прекращению лечения, чем у более молодых пациентов. Рекомендуется тщательное наблюдение за пациентами в возрасте ≥ 60 лет.
- В комбинации с доцетакселом: Повышенная частота побочных реакций, связанных с лечением, 3 или 4 степени и серьезных побочных реакций, связанных с лечением, наблюдалась у пациентов в возрасте 60 лет и старше (см. Раздел 5.1). Начальная доза капецитабина снижена до 75% (950 мг / сут). м2 два раза в день) у пациентов в возрасте 60 лет и старше.Если у пациентов старше 60 лет, получавших пониженную начальную дозу капецитабина в комбинации с доцетакселом, не наблюдается токсичности, дозу капецитабина можно осторожно увеличить до 1250 мг / м2 дважды ежедневно.
Педиатрическая популяция
Применение капецитабина в педиатрической популяции при показаниях рака толстой кишки, колоректального рака, желудка и молочной железы нецелесообразно.
Способ применения
Таблетки Кселоды следует проглатывать, запивая водой, в течение 30 минут после окончания еды.
04.3 Противопоказания
• В анамнезе тяжелые или неожиданные реакции на терапию фторпиримидином.
• Повышенная чувствительность к капецитабину или любому из вспомогательных веществ, перечисленных в разделе 6.1, или к фторурацилу.
• У пациентов с известным полным отсутствием активности дигидропиримидиндегидрогеназы (DPD) (см. Раздел 4.4).
• Во время беременности и кормления грудью.
• У пациентов с тяжелыми формами лейкопении, нейтропении или тромбоцитопении.
• У пациентов с тяжелой печеночной недостаточностью.
• У пациентов с тяжелой почечной недостаточностью (клиренс креатинина менее 30 мл / мин).
• Во время лечения соривудином или его химически родственными аналогами, такими как бривудин (см. Раздел 4.5).
• Если есть противопоказания к любому из лекарств в комбинированной схеме, это лекарство не следует использовать.
04.4 Особые предупреждения и соответствующие меры предосторожности при использовании
В ограничивающая дозу токсичность включают диарею, боль в животе, тошноту, стоматит и синдром кистей и стоп (кожная реакция кистей и стоп, ладонно-подошвенная эритродизестезия). Большинство побочных реакций обратимы и не требуют постоянного прекращения терапии, хотя может потребоваться прерывание или снижение дозы.
Понос. Пациенты с тяжелой диареей должны находиться под тщательным наблюдением и, в случае обезвоживания, давать жидкости и электролиты. Могут быть назначены стандартные противодиарейные препараты (например, лоперамид). Диарея 2 степени в соответствии с Общими критериями токсичности NCIC означает увеличение с 4 до 6 выделений в день или ночных выделений, при диарее 3 степени увеличение на 7-9 выделений в день или недержание мочи и мальабсорбция, а при диарее 4 степени и увеличение ≥10 выделений в день или сильно кровоточащая диарея или необходимость парентеральной поддержки. При необходимости следует уменьшить дозу (см. Раздел 4.2).
Обезвоживание. Обезвоживание необходимо предотвратить или исправить, если оно происходит. Пациенты с анорексией, астенией, тошнотой, рвотой или диареей могут быстро обезвоживаться. Обезвоживание может вызвать острую почечную недостаточность, особенно у пациентов с уже существующей почечной недостаточностью или когда капецитабин назначается в сочетании с известными нефротоксическими препаратами. Острая почечная недостаточность, вызванная обезвоживанием, может быть потенциально смертельной. Если происходит обезвоживание 2 степени (или выше), лечение капецитабином следует немедленно прекратить и устранить обезвоживание. Лечение не следует возобновлять до тех пор, пока у пациента не произойдет регидратация и пока не будет устранена или устранена любая провоцирующая причина. При необходимости следует изменить дозу для вызывающего нежелательное явление (см. Раздел 4.2).
Синдром ладони-стопы (также известна как кожная реакция ладонно-подошвенной эритродизестезии или эритема конечностей, вызванная химиотерапией). Синдром кисти и стопы 1 степени определяется как онемение, дизестезия / парестезия, покалывание, безболезненный отек или эритема рук и / или ног и / или дискомфорт, который не мешает пациенту нормально функционировать.
Синдром кисти и стопы 2 степени определяется как болезненная эритема и отек в руках и / или ногах и / или дискомфорт, влияющий на повседневную деятельность пациента.
Синдром кисти-стопы степени 3 определяется как влажное шелушение, изъязвление, образование пузырей и сильная боль в руках и / или ногах и / или сильный дискомфорт, который не позволяет пациенту работать или выполнять повседневную деятельность. Если степень 2 или 3 рука При возникновении синдрома стопы воздержитесь от приема капецитабина до тех пор, пока интенсивность симптомов не исчезнет или не снизится до 1 степени. После появления синдрома кисти и стопы 3 степени следует уменьшить последующие дозы капецитабина. Когда капецитабин и цисплатин используются в комбинации, использование витамина B6 (пиридоксина) для симптоматического или вторичного профилактического лечения синдрома кистей и стоп не рекомендуется, поскольку опубликованные случаи показали, что это может снизить эффективность цисплатина. Есть некоторые свидетельства того, что декспантенол эффективен для профилактики синдрома кисти и стопы у пациентов, принимающих Кселоду.
Кардиотоксичность. Терапия фторпиримидином связана с кардиотоксичностью, включая инфаркт миокарда, стенокардию, аритмию, кардиогенный шок, внезапную смерть и электрокардиографические изменения (включая очень редкие случаи удлинения интервала QT). Эти побочные реакции могут чаще возникать у пациентов с коронарной артерией в анамнезе. У пациентов, принимающих капецитабин, сообщалось о сердечной аритмии (включая фибрилляцию желудочков, пуантах и брадикардию), стенокардии, инфаркте миокарда, сердечной недостаточности и кардиомиопатии. Следует проявлять особую осторожность при значительной стенокардии (см. раздел 4.8).
Гипо- или гиперкальциемия. Сообщалось о случаях гипо- или гиперкальциемии во время лечения капецитабином. Особую осторожность следует проявлять пациентам с гипо- или гиперкальциемией в анамнезе (см. Раздел 4.8).
Заболевания центральной или периферической нервной системы. Пациентов с заболеваниями центральной или периферической нервной системы, например, с метастазами в головной мозг или невропатией, следует рассматривать с осторожностью (см. Раздел 4.8).
Сахарный диабет или нарушение электролитного баланса. Следует с осторожностью рассматривать пациентов с сахарным диабетом или электролитными нарушениями, учитывая возможность обострения во время лечения капецитабином.
Антикоагулянты на основе кумарина. В исследовании взаимодействия с приемом однократной дозы варфарина наблюдалось значительное увеличение средней AUC (+ 57%) S-варфарина. Эти данные предполагают «взаимодействие, возможно, из-за» ингибирования изофермента 2C9 цитохрома P450 капецитабином. Пациентов, принимающих пероральные антикоагулянты на основе кумарина вместе с капецитабином, следует регулярно контролировать на предмет любых отклонений в параметрах артериального давления. Свертывание крови (INR или протромбиновое время) ) и дозу антикоагулянтов следует соответственно скорректировать (см. раздел 4.5).
Нарушение функции печени. Ввиду отсутствия данных о безопасности и эффективности у пациентов с нарушением функции печени применение капецитабина следует тщательно контролировать у пациентов с нарушением функции печени легкой и средней степени, независимо от наличия или отсутствия метастазов в печени. Прием капецитабина следует прекратить, если Возникает связанное с лечением повышение уровня билирубина более 3,0 x ULN или связанное с лечением повышение аминотрансфераз печени (ALT, AST) более 2,5 x ULN. Монотерапия может быть возобновлена, когда билирубин снижается до ≤3,0 x ULN или когда аминотрансферазы печени снижаются до ≤2,5 х ULN.
Нарушение функции почек. Частота побочных реакций 3 или 4 степени у пациентов с умеренной почечной недостаточностью (клиренс креатинина 30–50 мл / мин) выше, чем в общей популяции (см. Разделы 4.2 и 4.3).
Дефицит дигидропиримидиндегидрогеназы (DPD): Редкая, неожиданная и тяжелая токсичность (например, стоматит, диарея, мукозит, нейтропения и нейротоксичность), связанная с 5-ФУ, связана с дефицитом активности DPD.
Пациенты с низкой активностью или отсутствием активности DPD, фермента, участвующего в расщеплении фторурацила, подвергаются повышенному риску серьезных, опасных для жизни или фатальных побочных реакций, вызванных фторурацилом. Хотя дефицит DPD не может быть точно идентифицирован, известно, что пациенты с определенными гомозиготными или компаунд-гетерозиготными мутациями локуса гена DPYD, которые вызывают полное или почти полное отсутствие ферментативной активности DPD (как определено лабораторным анализом), имеют наибольший риск опасной для жизни или смертельной токсичности и не должны лечиться Кселодой (см. раздел 4.3). Было обнаружено, что ни одна доза не является безопасной для пациентов с полным отсутствием активности DPD.
Пациенты с частичной недостаточностью DPD (например, с гетерозиготными мутациями в DPYD), для которых польза от Кселоды, как считается, перевешивает ее риски (с учетом целесообразности альтернативного режима химиотерапии, не содержащего флуопиримидин), следует рассматривать с особой осторожностью и часто контролировать с корректировкой дозы в соответствии с токсичностью. Данных недостаточно. рекомендовать конкретную дозу для пациентов с частичной активностью DPD, измеренной с помощью специального теста.
Опасные для жизни токсические эффекты, такие как эпизоды острой передозировки, могут возникать у пациентов с неустановленным дефицитом DPD, получающих капецитабин (см. Раздел 4.9). В случае острой токсичности 2-4 степени лечение следует немедленно прекратить. Следует рассмотреть возможность окончательного прекращения лечения на основании клинической оценки начала, продолжительности и тяжести наблюдаемых токсических эффектов.
Офтальмологические осложнения: Пациенты должны находиться под тщательным наблюдением на предмет офтальмологических осложнений, таких как кератит и заболевания роговицы, особенно если у них в анамнезе есть заболевания глаз. Лечение глазных болезней следует начинать клинически приемлемым способом.
Тяжелые кожные реакции: Кселода может вызывать серьезные кожные реакции, такие как синдром Стивенса-Джонсона и токсический эпидермальный некролиз. У пациентов, у которых наблюдается тяжелая кожная реакция во время лечения Кселодой, прием этого лекарства следует полностью прекратить.
Поскольку это лекарственное средство содержит безводную лактозу в качестве вспомогательного вещества, пациенты с редкими наследственными формами непереносимости галактозы, дефицитом фермента лактазы Лаппа и мальабсорбцией глюкозы-галактозы не должны принимать это лекарство.
04.5 Взаимодействие с другими лекарственными средствами и другие формы взаимодействия
Исследования взаимодействия проводились только на взрослых.
Взаимодействие с другими лекарствами:
Субстраты цитохрома Р-450 2С9: Помимо исследований варфарина, официальных исследований лекарственного взаимодействия между капецитабином и другими субстратами CYP2C9 не проводилось. Следует соблюдать осторожность при назначении капецитабина вместе с субстратами 2C9 (например, фенитоином). См. Также взаимодействие с другими антикоагулянтами на основе кумарина и раздел 4.4.
Антикоагулянты на основе кумарина: у пациентов, получавших одновременно капецитабин и антикоагулянты на основе кумарина, такие как варфарин и фенпрокумон, не сообщалось об изменениях параметров свертывания и / или кровотечениях. Эти реакции возникали в течение от нескольких дней до нескольких месяцев после начала терапии капецитабином и, в некоторых случаях, в течение одного месяца после прекращения терапии капецитабином. В исследовании клинического фармакокинетического взаимодействия после введения однократной дозы варфарина 20 мг лечение капецитабином увеличивало AUC S-варфарина на 57% с увеличением INR на 91%. Поскольку метаболизм R-варфарина не изменился, эти данные позволяют предположить, что капецитабин снижает уровень изофермента 2C9, но не влияет на изоферменты 1A2 и 3A4. Пациентов, принимающих антикоагулянты на основе кумарина одновременно с капецитабином, следует регулярно контролировать на предмет возможных изменений в организме. Параметры коагуляции (ПВ или МНО) и дозировка антикоагулянтов должны быть соответственно скорректированы.
Фенитоин: Повышение концентрации фенитоина в плазме было зарегистрировано при одновременном применении капецитабина и фенитоина, что в отдельных случаях приводило к появлению симптомов фенитоиновой интоксикации. Пациентов, принимающих фенитоин одновременно с капецитабином, следует регулярно контролировать на предмет любых повышенных концентраций фенитоина в плазме.
Фолиновая кислота / фолиевая кислота: Исследование, включающее комбинацию капецитабина и фолиновой кислоты, показало, что фолиевая кислота не оказывает значительного влияния на фармакокинетику капецитабина и его метаболитов. Однако фолиновая кислота оказывает влияние на фармакодинамику капецитабина, токсичность которого может быть увеличена фолиновой кислотой: максимальная переносимая доза (МПД) монотерапии капецитабином при прерывистых схемах составляет 3000 мг / м2 в день, тогда как при сочетании капецитабина с фолиевой кислотой ( 30 мг перорально два раза в день) максимальная переносимая доза упала до 2000 мг / м2 в день. Повышение токсичности может иметь значение при переходе с 5-ФУ / LV на схему на основе капецитабина. Из-за сходства между фолиевой кислотой и фолиевой кислотой повышенная токсичность также может иметь значение при добавлении фолиевой кислоты при лечении дефицита фолиевой кислоты. .
Соривудин и аналоги: Сообщалось о клинически значимом лекарственном взаимодействии между соривудином и 5-ФУ в результате ингибирования соривудином дигидропиримидиндегидрогеназы. Это взаимодействие, которое приводит к повышенной токсичности фторпиримидина, потенциально смертельно. По этой причине капецитабин не следует назначать одновременно с соривудином или его химически родственными аналогами, такими как бривудин (см. Раздел 4.3). Между окончанием лечения соривудином или его химически родственными аналогами, такими как бривудин, и началом терапии капецитабином следует соблюдать период отдыха не менее 4 недель.
Антациды: Было исследовано влияние антацида, содержащего гидроксид алюминия и гидроксид магния, на фармакокинетику капецитабина. Было обнаружено небольшое увеличение концентрации капецитабина и метаболита в плазме крови (5 "-DFCR); не было никакого эффекта на 3 основных метаболита (5 "-DFUR, 5-FU и FBAL).
Аллопуринол: Наблюдались взаимодействия 5-ФУ с аллопуринолом с возможным снижением эффективности 5-ФУ. Следует избегать одновременного применения аллопуринола и капецитабина.
Интерферон альфа: максимальная переносимая доза (МПД) капецитабина составляла 2000 мг / м2 в день при приеме в комбинации с интерфероном альфа-2а (3 MIU / м2 в день) по сравнению с 3000 мг / м2 в день, когда капецитабин вводился отдельно.
Лучевая терапия: Максимальная переносимая доза (МПД) монотерапии капецитабином при прерывистом режиме составляет 3000 мг / м2 в день, в то время как в сочетании с лучевой терапией рака прямой кишки максимальная переносимая доза (МПД) капецитабина составляет 2000 мг / м2 в день при использовании либо непрерывное дозирование, либо ежедневное дозирование с понедельника по пятницу в сочетании с 6-недельным циклом лучевой терапии.
Оксалиплатин: Не было клинически значимой разницы в воздействии капецитабина или его метаболитов, свободной платины или общей платины, когда капецитабин вводился в комбинации с оксалиплатином или в комбинации с оксалиплатином и бевацизумабом.
Бевацизумаб: Не было клинически значимого влияния бевацизумаба на фармакокинетические параметры капецитабина или его метаболитов в присутствии оксалиплатина.
Взаимодействие с едой
Во всех клинических исследованиях пациентам рекомендовалось принимать капецитабин в течение 30 минут после еды. Поскольку текущие данные по безопасности и эффективности основаны на приеме лекарственного препарата с пищей, рекомендуется назначать капецитабин с пищей. Введение с пищей снижает скорость абсорбции капецитабина (см. Раздел 5.2).
04.6 Беременность и кормление грудью
Женщины детородного возраста / Противозачаточные средства у мужчин и женщин
Женщинам детородного возраста следует рекомендовать избегать риска беременности во время лечения капецитабином. Если беременность наступает во время лечения капецитабином, пациентку следует проинформировать о потенциальном риске для плода. Во время лечения следует использовать эффективный метод контрацепции.
Беременность
Исследования капецитабина у беременных женщин не проводились; однако можно предположить, что капецитабин при введении беременным женщинам может нанести вред плоду. В исследованиях репродуктивной токсичности на животных введение капецитабина приводило к эмбриональной летальности и тератогенности. Эти результаты являются ожидаемыми эффектами производных фторпиримидина. Капецитабин противопоказан при беременности.
Время кормления
Неизвестно, выделяется ли капецитабин с грудным молоком. В молоке кормящих мышей были обнаружены значительные количества капецитабина и его метаболитов. В период лечения капецитабином кормление грудью следует прекратить.
Плодородие
Нет данных о Кселоде и ее влиянии на фертильность. Основные исследования Кселоды включали женщин с детородным потенциалом и мужчин, только если они были готовы использовать адекватные средства контрацепции на время исследования и в течение разумного периода после этого, чтобы избежать беременности.
Влияние на фертильность наблюдали в исследованиях на животных (см. Раздел 5.3).
04.7 Влияние на способность управлять автомобилем и работать с механизмами
Капецитабин оказывает незначительное или умеренное влияние на способность управлять автомобилем или механизмами. Капецитабин может вызывать головокружение, усталость и тошноту.
04.8 Побочные эффекты
Резюме профиля безопасности
Общий профиль безопасности капецитабина основан на данных более чем 3000 пациентов, получавших только капецитабин или капецитабин в сочетании с различными режимами химиотерапии по нескольким показаниям. Профили безопасности монотерапии капецитабином в популяциях пациентов с метастатическим раком молочной железы, метастатическим колоректальным раком и адъювантным раком толстой кишки аналогичны. См. Раздел 5.1 для получения подробной информации об основных исследованиях, включая дизайн исследований и ключевые результаты эффективности.
Наиболее частыми и / или клинически значимыми побочными реакциями, связанными с лечением, были желудочно-кишечные расстройства (особенно диарея, тошнота, рвота, боль в животе, стоматит), синдром кистей и стоп (ладонно-подошвенная эритродизестезия), утомляемость, астения, анорексия, кардиотоксичность, ухудшение функции почек, когда функция уже была нарушена, и тромбоз / эмболия.
Резюме побочных реакций в табличной форме
Нежелательные реакции, которые, по мнению исследователя, могут быть, вероятно или отдаленно связаны с введением капецитабина, перечислены в таблице 4 для приема только капецитабина и в таблице 5 для приема капецитабина в сочетании с различными режимами химиотерапии по множеству показаний. Следующие термины используются для классификации ADR в соответствии с их частотой: очень часто (≥ 1/10), часто (≥ 1/100,
Монотерапия капецитабином:
В таблице 4 перечислены нежелательные реакции, связанные с применением монотерапии капецитабином, на основе объединенного анализа данных о безопасности из трех основных исследований, включающих более 1900 пациентов (исследования M66001, SO14695 и SO14796). Нежелательные реакции были включены в конкретную группу частоты в соответствии с «общей заболеваемостью, полученной на основе совокупного анализа».
Таблица 4 Сводка связанных побочных эффектов, зарегистрированных у пациентов, получавших монотерапию капецитабином.
Капецитабин в комбинированной терапии:
В таблице 5 перечислены нежелательные реакции, связанные с применением капецитабина в сочетании с различными схемами химиотерапии по нескольким показаниям, на основе данных о безопасности более 3000 пациентов. Побочные реакции были включены в конкретную группу частоты (очень часто или часто) на основе самой высокой частоты встречаемости. наблюдались в основных клинических исследованиях и только в дополнение к тем, которые наблюдались при монотерапии капецитабином, или если они принадлежали к группе с более высокой частотой, чем монотерапия капецитабином (см. таблицу 4). Необычные нежелательные реакции, сообщаемые для капецитабина при комбинированной терапии, согласуются с нежелательными реакциями, указанными для монотерапии капецитабином или для монотерапии комбинированными лекарственными средствами (в литературе и / или соответствующих SPC).
Некоторые из побочных эффектов являются реакциями, которые часто наблюдаются при приеме комбинированного лекарственного средства (например, периферическая сенсорная нейропатия при приеме доцетаксела или оксалиплатина, гипертензия при приеме бевацизумаба); однако нельзя исключить ухудшение, вызванное терапией капецитабином.
Таблица 5 Сводная информация о нежелательных реакциях, зарегистрированных у пациентов, получавших капецитабин в составе комбинированной терапии в дополнение к тем, которые наблюдались при использовании одного капецитабина или наблюдались в группе с более высокой частотой по сравнению с одним капецитабином.
+ Для каждого срока частота рассчитывалась на основе ADR всех классов. Для условий, отмеченных знаком «+», частота рассчитывалась на основе ADR 3-4 степени. Нежелательные реакции были включены на основании самой высокой частоты встречаемости, наблюдаемой в основных клинических испытаниях комбинированной терапии.
Описание ряда побочных реакций
Синдром ладони-стопы (см. Раздел 4.4):
В исследованиях монотерапии капецитабином (включая исследования адъювантной терапии рака толстой кишки, лечения метастатического колоректального рака и лечения рака груди) капецитабином 1250 мг / м2 два раза в день в дни с 1 по 14 каждые три недели, синдром ладонно-стопного синдрома любой степени наблюдается с частотой от 53% до 60%; в группе капецитабина / доцетаксела для лечения метастатического рака молочной железы частота составила 63%. При комбинированной терапии капецитабином и капецитабином 1000 мг / м2 два раза в день в дни с 1 по 14 каждые три недели наблюдалась любая степень синдрома кисти и стопы с частотой от 22% до 30%.
В рамках метаанализа 14 клинических испытаний с данными более 4700 пациентов, получавших монотерапию капецитабином или капецитабином в сочетании с различными режимами химиотерапии по множественным показаниям (рак толстой кишки, колоректального рака, желудка и груди), синдром ладонно-стопного синдрома любая степень наступила у 2066 пациентов (43%) в среднем через 239 дней (95% ДИ: 201, 288) от начала лечения капецитабином. Во всех комбинированных исследованиях наблюдалась «статистически значимая связь между следующими ковариатами и повышенным риском развития синдрома кистей и стоп: увеличение начальной дозы капецитабина (в граммах), снижение кумулятивной дозы капецитабина (0,1 * кг), увеличение относительной дозы». интенсивность дозы в первые 6 недель, увеличенная продолжительность исследуемого лечения (недели), пожилой возраст (увеличение на 10 лет), женский пол и хорошее исходное состояние по ECOG (0 против ≥1).
Диарея (см. Раздел 4.4):
Капецитабин может вызвать диарею, которая наблюдается у 50% пациентов.
Результаты метаанализа 14 клинических исследований с данными более чем 4700 пациентов, получавших капецитабин, показали, что во всех комбинированных исследованиях наблюдалась «статистически значимая связь между следующими ковариатами и повышенным риском развития диареи: увеличенная начальная доза препарата. капецитабин (грамм), увеличенная продолжительность исследуемого лечения (недели), пожилой возраст (с шагом 10 лет) и женский пол. Статистически значимая связь наблюдалась между следующими ковариатами и снижением риска развития диареи: увеличение кумулятивной дозы капецитабина (0,1 * кг) и увеличение относительной интенсивности дозы в первые 6 недель.
Кардиотоксичность (см. Раздел 4.4):
В дополнение к нежелательным реакциям, описанным в таблицах 4 и 5, на основе «объединенного анализа данных клинической безопасности из 7 клинических исследований с участием 949 пациентов (2 исследования фазы III и 5 исследований фазы II при метастатическом колоректальном раке) и при метастатическом раке молочной железы», Следующие побочные эффекты с частотой менее 0,1% наблюдались в связи с применением только капецитабина: кардиомиопатия, сердечная недостаточность, внезапная смерть и желудочковые экстрасистолии.
Энцефалопатия:
В дополнение к ADR, описанным в таблицах 4 и 5, на основе вышеупомянутого объединенного анализа данных клинической безопасности из 7 клинических исследований, использование только капецитабина также было связано с энцефалопатией с частотой менее 0,1%.
Особые группы населения
Пожилые пациенты (см. Раздел 4.2):
«Анализ данных о безопасности у пациентов в возрасте ≥ 60 лет, получавших монотерапию капецитабином, и» анализ пациентов, получавших терапевтическую комбинацию капецитабина и доцетаксела, показали повышенную частоту побочных реакций 3 и 4 степени, связанных с лечением и связанных с лечением. серьезные побочные реакции по сравнению с пациентами младше 60 лет. Кроме того, пациенты в возрасте ≥60 лет, получавшие капецитабин и доцетаксел, преждевременно прекращали лечение из-за более частых побочных реакций, чем пациенты в возрасте до 60 лет.
Результаты метаанализа 14 клинических исследований с данными более чем 4700 пациентов, получавших капецитабин, показали, что во всех исследованиях, вместе взятых, наблюдалась «статистически значимая связь между» увеличением возраста (с увеличением на 10 лет) и повышенным риском. развития синдрома кисти и стопы и диареи, а также снижения риска развития нейтропении.
Секс
Результаты метаанализа 14 клинических испытаний с данными более чем 4700 пациентов, получавших капецитабин, показали, что во всех исследованиях, вместе взятых, наблюдалась «статистически значимая связь между женским полом и повышенным риском развития синдрома. диарея и снижение риска развития нейтропении.
Пациенты с почечной недостаточностью (см. Разделы 4.2, 4.4 и 5.2):
Анализ данных по безопасности у пациентов, получавших монотерапию капецитабином (колоректальный рак) с почечной недостаточностью на исходном уровне, показал повышенную частоту побочных реакций 3 и 4 степени, связанных с лечением, по сравнению с пациентами с нормальной функцией почек (36% у пациентов без почечной недостаточности n = 268 против 41% при легких нарушениях n = 257 и 54% при умеренных n = 59, соответственно) (см. Раздел 5.2). Увеличение скорости снижения дозы (44%) наблюдалось у пациентов с нарушением функции почек средней степени по сравнению с 33% и 32% у пациентов с легким нарушением функции почек или без него, а также увеличение частоты преждевременного прекращения лечения (21% перерывов в течение первых двух дней). циклов) по сравнению с 5% и 8% у пациентов с незначительной почечной недостаточностью или без нее.
Сообщение о предполагаемых побочных реакциях
Отчетность о предполагаемых побочных реакциях, возникающих после получения разрешения на лекарственный препарат, важна, поскольку позволяет осуществлять непрерывный мониторинг баланса пользы / риска лекарственного средства. Медицинских работников просят сообщать о любых предполагаемых побочных реакциях через национальную систему отчетности www .agenziafarmaco.gov .it / it / ответственный.
04.9 Передозировка
Проявления острой передозировки включают тошноту, рвоту, диарею, мукозит, раздражение и кровотечение желудочно-кишечного тракта, а также угнетение костного мозга. Клиническое лечение передозировки должно осуществляться с помощью традиционной терапии и поддерживающего медицинского вмешательства для коррекции имеющихся клинических проявлений и предотвращения их возможных осложнений.
05.0 ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
05.1 Фармакодинамические свойства
Фармакотерапевтическая группа: цитостатик (антиметаболит).
Код УВД: L01BC06.
Капецитабин представляет собой нецитотоксический карбамат фторпиримидина, который действует как пероральный предшественник цитотоксической формы 5-фторурацила (5-FU). Капецитабин активируется несколькими ферментативными стадиями (см. Раздел 5.2). Фермент, участвующий в окончательном превращении в 5-ФУ, тимидинфосфорилазу (ThyPase), обнаруживается в опухолевых тканях, но также и в нормальных тканях, хотя, как правило, в более низкой концентрации. синергетический эффект в комбинации с доцетакселом, который может быть связан с гиперрегуляцией тимидинфосфорилазы доцетакселом.
Было обнаружено, что метаболизм 5-ФУ в анаболическом пути блокирует реакцию метилирования дезоксиуридиловой кислоты до тимидиловой кислоты, тем самым препятствуя синтезу дезоксирибонуклеиновой кислоты (ДНК). Включение 5-FU также приводит к ингибированию синтеза РНК и белка. Поскольку ДНК и РНК необходимы для деления и роста клеток, 5-ФУ может приводить к дефициту тимидина, что вызывает несбалансированный рост и гибель клеток. Эффекты депривации ДНК и РНК особенно заметны в клетках, которые быстрее растут и быстрее метаболизируют 5-ФУ.
Рак толстой кишки и толстой кишки:
Монотерапия капецитабином в адъювантном лечении рака толстой кишки
Данные многоцентрового рандомизированного контролируемого клинического исследования фазы III у пациентов с раком толстой кишки III стадии (Dukes C) подтверждают использование капецитабина в качестве адъювантной терапии у пациентов с раком толстой кишки (исследование X-ACT, M66001). В этом исследовании 1987 г. Пациенты были рандомизированы для лечения капецитабином (1250 мг / м2 два раза в день в течение 2 недель, с последующим перерывом на 1 неделю в виде 3-недельных циклов в течение 24 недель) или 5-ФУ и лейковорином (расписание клиники Мэйо: лейковорин 20 мг / м2 внутривенно. с последующим введением болюса 5-ФУ 425 мг / м2 внутривенно, в дни с 1 по 5, каждые 28 дней в течение 24 недель). Капецитабин был, по крайней мере, эквивалентен 5-ФУ / ЛВ внутривенно в безрецидивной выживаемости в популяции согласно протоколу (HR 0,92; 95% ДИ: 0,80-1,06). Выживаемость без признаков заболевания и общая выживаемость показали HR 0,88. (95% ДИ: 0,77–1,01; p = 0,068) и 0,86 (95% ДИ: 0,74–1,01; p = 0,060) соответственно. Среднее время наблюдения на момент анализа составляло 6,9 года. В ранее запланированном многофакторном анализе Кокса было продемонстрировано превосходство капецитабина над болюсом 5-ФУ / ЛВ. Следующие факторы были предварительно определены в статистическом анализе для включения в модель: возраст, время от операции до рандомизации, пол, исходные уровни CEA, исходные лимфатические узлы и страна. В рандомизированной популяции было показано, что капецитабин превосходит 5-ФУ / ЛВ как с точки зрения выживаемости без признаков заболевания (ОР: 0,849; 95% ДИ: 0,739-0,976; p = 0,0212), так и с точки зрения общей выживаемости (ОР : 0,828; 95% ДИ: 0,705-0,971; p = 0,0203).
Комбинированная терапия в адъювантном лечении рака толстой кишки
Данные многоцентрового рандомизированного контролируемого клинического исследования фазы III у пациентов с раком толстой кишки III стадии (Dukes C) подтверждают использование капецитабина в сочетании с оксалиплатином (XELOX) для адъювантного лечения пациентов с раком толстой кишки (исследование NO16968). В этом исследовании 944 пациента были рандомизированы для лечения капецитабином (1000 мг / м2 два раза в день в течение 2 недель, с последующей 1 неделей перерыв в виде 3-недельных курсов в течение 24 недель) в сочетании с оксалиплатином (130 мг / м2 в виде внутривенной инфузии). в течение 2 часов в день 1 каждые 3 недели); 942 пациента были рандомизированы для лечения болюсным 5-ФУ и лейковорином. При первичном анализе DFS в популяции ITT было показано, что XELOX значительно превосходит 5-ФУ / LV ( HR = 0,80, 95% CI = [0,69; 0,93]; p = 0,0045). Частота 3-летнего DFS составила 71% в группе XELOX по сравнению с 67% в группе 5-FU / LV. Анализ, проведенный для вторичной конечной точки RFS, подтверждает эти результаты с HR 0,78 (95% ДИ = [0,67; 0,92]; p = 0,0024) в группе XELOX по сравнению с группой, получавшей 5-FU / LV. XELOX продемонстрировал тенденцию к превосходству с точки зрения ОС с HR 0,87 (95% ДИ = [0,72, 1,05]; p = 0,1486), что означает снижение риска смерти на 13%. Скорость 5-летнего OS составила 78% для XELOX по сравнению с 74% для 5-FU / LV. Данные по эффективности основаны на среднем времени наблюдения 59 месяцев для OS и 57 месяцев для DFS. Частота выхода из исследования по причине нежелательных явлений была выше в группе XELOX (21%) по сравнению с группой монотерапии 5-FU / LV. (9%) в ITT-популяции.
Монотерапия капецитабином при метастатическом колоректальном раке
Данные двух многоцентровых рандомизированных контролируемых клинических исследований III фазы (SO14695: SO14796) с аналогичным дизайном подтверждают использование капецитабина для лечения первой линии метастатического колоректального рака. В этих исследованиях 603 пациента были рандомизированы для лечения капецитабином (1250 мг). / м2 два раза в день в течение 2 недель с последующей недельной перерывом и 3-недельными циклами). 604 пациента были рандомизированы для лечения 5-ФУ и лейковорином (схема Мэйо: 20 мг / м2 внутривенно лейковорин, затем 425 пациентов. внутривенное болюсное введение 5-ФУ в мг / м2 в дни с 1 по 5, каждые 28 дней) (исследователь) составило: 25,7% (капецитабин) по сравнению с 16,7% (режим Майо); п
Комбинированная терапия в терапии первой линии метастатического колоректального рака
Данные многоцентрового рандомизированного контролируемого клинического исследования III фазы (NO16966) подтверждают использование капецитабина в сочетании с оксалиплатином или в комбинации с оксалиплатином и бевацизумабом для лечения первой линии метастатического колоректального рака. Исследование включало две части: первые две - часть руки, в которой 634 пациента были рандомизированы для двух различных схем лечения, то есть XELOX или FOLFOX-4, и последующая 2x2 факторная часть, в которой 1401 пациент был рандомизирован для четырех различных схем лечения. лечение, то есть XELOX плюс плацебо, FOLFOX-4 плюс плацебо, XELOX плюс бевацизумаб и FOLFOX-4 плюс бевацизумаб Схемы лечения см. в таблице 6.
Таблица 6 Схемы лечения в исследовании NO16966 (mCRC)
В общем сравнении была продемонстрирована не меньшая эффективность групп, содержащих XELOX, по сравнению с группами, содержащими FOLFOX-4, с точки зрения выживаемости без прогрессирования в популяции подходящих пациентов и популяции, собирающейся лечиться (см. Таблицу 7). Результаты показывают, что XELOX эквивалентен FOLFOX-4 с точки зрения общей выживаемости (см. Таблицу 7). Сравнение XELOX плюс бевацизумаб с FOLFOX-4 плюс бевацизумаб состояло из «заранее запланированного исследовательского анализа. При сравнении этих подгрупп лечения XELOX плюс бевацизумаб был аналогичен FOLFOX-4 плюс бевацизумаб с точки зрения выживаемости без прогрессирования заболевания (отношение рисков 1,01; 97,5% ДИ: 0,84 - 1,22). Медиана последующего наблюдения во время первичного анализа в популяции, планирующей лечение, составляла 1,5 года; данные, полученные после следующего года наблюдения, также включены в таблицу 7. Анализ ВБП во время лечения, однако, не подтвердил результаты анализа общей ВБП и ОВ: отношение рисков XELOX по сравнению с FOLFOX -4 составляло 1,24 с 97,5% ДИ: 1,07 - 1,44. Хотя анализ чувствительности показывает, что различия в режимах время планирования и оценки опухоли влияет на текущий анализ PFS лечения, окончательного объяснения этому не было найдено результат.
Таблица 7 Ключевые результаты эффективности для анализа не меньшей эффективности исследования NO16966
* СИЗ = совокупность подходящих пациентов; ** ITT = популяция, намеренная лечиться.
В рандомизированном контролируемом исследовании фазы III (CAIRO) изучали влияние капецитабина в начальной дозе 1000 мг / м2 в течение 2 недель каждые 3 недели в сочетании с иринотеканом для лечения первой линии. Пациентов с метастатическим колоректальным поражением рак. 820 пациентов были рандомизированы для получения последовательного (n = 410) или комбинированного (n = 410) лечения. Последовательное лечение включало лечение первой линии капецитабином (1250 мг / м2 два раза в день в течение 14 дней), лечение второй линии иринотеканом (350 мг / м2 в день 1) и комбинацию третьей линии с капецитабином (1000). мг / м2 два раза в день в течение 14 дней) и оксалиплатина (130 мг / м2 в день 1). Комбинированное лечение состояло из лечения первой линии капецитабином (1000 мг / м2 два раза в день в течение 14 дней) в сочетании с иринотеканом (250 мг / м2. в день 1) (XELIRI) и вторая линия капецитабина (1000 мг / м2 два раза в день в течение 14 дней) плюс оксалиплатин (130 мг / м2 в день 1). вводились с 3-недельными интервалами. медиана выживаемости без прогрессирования заболевания в популяции, планирующей лечение, составила 5,8 месяцев (95% ДИ; 5,1–6,2 месяца) для монотерапии капецитабином и 7,8 месяцев (95% ДИ: 7,0–8,3 месяца; p = 0,0002) для XELIRI. это было связано с увеличением частоты желудочно-кишечной токсичности и нейтропении во время лечения первой линии XELIRI (26% и 11% для XELIRI и капецитабина первой линии, соответственно).
В трех рандомизированных исследованиях с участием пациентов с метастатическим колоректальным раком схема XELIRI сравнивалась с 5-ФУ + иринотекан (FOLFIRI). Режимы XELIRI включали капецитабин 1000 мг / м2 два раза в день в дни с 1 по 14 трехнедельного цикла в сочетании с иринотеканом 250 мг / м2 в день 1. В более крупном исследовании (BICC-C) пациенты были рандомизированы в открытое лечение FOLFIRI (n = 144), болюсное введение 5-FU (mIFL) (n = 145) или XELIRI (n = 141) с последующей рандомизацией на двойной слепой прием целекоксиба или плацебо. Медиана ВБП составила 7,6 месяцев для FOLFIRI, 5,9 месяцев для mIFL (p = 0,004 для сравнения с FOLFIRI) и 5,8 месяцев для XELIRI (p = 0,015). Медиана ОВ составила 23,1 месяца для FOLFIRI, 17,6 месяцев для mIFL (p = 0,09) и 18,9 месяцев для XELIRI (p = 0,27). Пациенты, получавшие XELIRI, испытали чрезмерную желудочно-кишечную токсичность по сравнению с пациентами, получавшими FOLFIRI (48% и 14% диарея для XELIRI и FOLFIRI соответственно).
В исследовании EORTC пациенты были рандомизированы для открытого лечения FOLFIRI (n = 41) или XELIRI (n = 44), а затем рандомизированы на двойное слепое лечение целекоксибом или плацебо. Медиана PFS и общая выживаемость (OS) были ниже для XELIRI по сравнению с FOLFIRI (PFS 5,9 против 9,6 месяцев и OS 14,8 против 19,9 месяцев); Кроме того, у пациентов, получавших схему XELIRI, сообщалось о чрезмерной частоте диареи (41% XELIRI; 5,1% FOLFIRI).
В исследовании, опубликованном Skof и другие., пациенты были рандомизированы для получения либо FOLFIRI, либо XELIRI. Общая частота ответов составила 49% в группе XELIRI и 48% в группе FOLFIRI (p = 0,76). В конце лечения 37% пациентов в группе XELIRI и 26% пациентов в группе FOLFIRI не имели признаков заболевания (p = 0,56). Токсичность была одинаковой при разных курсах лечения, за исключением нейтропении, о которой чаще всего сообщалось у пациентов, получавших FOLFIRI.
Montagnani et al. они использовали результаты трех вышеупомянутых исследований для обеспечения «глобального анализа рандомизированных исследований, сравнивающих терапевтические схемы FOLFIRI и XELIRI при лечении mCRC». Значительное снижение риска прогрессирования заболевания было связано с лечением FOLFIRI (ОР 0,76; 95% ДИ: 0,62-0,95; p
Данные рандомизированного клинического исследования (Souglakos и другие., 2012) сравнения между FOLFIRI + бевацизумаб и XELIRI + бевацизумаб не показали значительных различий в показателях ВБП и ОВ между лечением. Пациенты были рандомизированы для лечения FOLFIRI плюс бевацизумаб (группа A, n = 167) или XELIRI плюс бевацизумаб (группа B, n = 166). Для группы B в схеме XELIRI использовался капецитабин 1000 мг / м2 дважды в день в течение 14 дней + иринотекан 250 мг / м2 в день 1. Для лечения FOLFIRI-Bev и лечения XELIRI-Bev, соответственно, медиана выживаемости без прогрессирования (ВБП ), общая выживаемость и частота ответа были следующими: 10,0 месяцев и 8,9 месяцев (p = 0,64); 25,7 месяцев и 27,5 месяцев (p = 0,55); 45,5% и 39,8% (p = 0,32). Пациенты, получавшие XELIRI + бевацизумаб, сообщили о значительно более высокой частоте диареи, фебрильной нейтропении и кожных реакций на кистях и стопах по сравнению с пациентами, получавшими FOLFIRI + бевацизумаб, со значительным увеличением отсрочки лечения, снижения доз и перерывов в лечении.
Данные фазы II многоцентрового рандомизированного контролируемого исследования (AIO KRK 0604) подтверждают использование капецитабина в начальной дозе 800 мг / м2 в течение 2 недель каждые 3 недели в сочетании с иринотеканом и бевацизумабом для лечения. пациенты с метастатическим колоректальным раком.
120 пациентов были рандомизированы в группу модифицированного режима XELIRI, включающего капецитабин 800 мг / м2 два раза в день в течение двух недель с последующими 7 днями отдыха), иринотекан (200 мг / м2 в виде 30-минутной инфузии в день 1 каждые 3 недели) и бевацизумаб. (7,5 мг / кг вводят в течение 30-90 минут в 1-й день каждые 3 недели); 127 пациентов были рандомизированы для лечения капецитабином (1000 мг / м2 два раза в день в течение двух недель с последующими 7 днями отдыха), оксалиплатином (130 мг / м2 в виде 2-часовой инфузии в день 1 каждые 3 недели) и бевацизумаба (7,5 мг. / кг настаивается от 30 до 90 минут в день 1 каждые 3 недели).После средней продолжительности наблюдения в исследуемой популяции 26,2 месяца ответы на лечение были следующими:
Таблица 8 Результаты исследования эффективности AIO KRK
Комбинированная терапия при лечении метастатического колоректального рака второй линии
Данные фазы III многоцентрового рандомизированного контролируемого клинического исследования (NO16967) подтверждают использование капецитабина в сочетании с оксалиплатином для лечения второй линии метастатического колоректального рака. В этом исследовании 627 пациентов с метастатическим колоректальным раком, которые получали ранее лечение с иринотеканом в сочетании с режимом на основе фторпиримидина в качестве лечения первой линии были рандомизированы для лечения XELOX или FOLFOX-4. Режим дозирования XELOX и FOLFOX-4 (без добавления плацебо или бевацизумаба) см. в таблице 6. Было продемонстрировано, что XELOX не уступает FOLFOX-4 с точки зрения выживаемости без прогрессирования в протоколе и популяции, получавшей лечение (см. Таблицу 9). Результаты показывают, что XELOX эквивалентен FOLFOX-4 с точки зрения общей выживаемости. (см. таблицу 9). Медиана последующего наблюдения во время первичного анализа в популяции, собирающейся лечиться, составляла в 2,1 года; данные анализов, выполненных после следующих 6 месяцев наблюдения, также включены в таблицу 9.
Таблица 9 Ключевые результаты эффективности для анализа не меньшей эффективности исследования NO16967
* PPP = популяция согласно протоколу; ** ITT = популяция, намеренная лечиться.
Распространенный рак желудка:
Данные многоцентрового рандомизированного контролируемого клинического исследования фазы III у пациентов с распространенным раком желудка подтверждают использование капецитабина в качестве первой линии лечения распространенного рака желудка (ML17032). В этом исследовании рандомизировано 160 пациентов. Лечение капецитабином ( 1000 мг / м2 два раза в день в течение 2 недель с последующими 7 днями отдыха) и цисплатин (80 мг / м2 в виде 2-часовой инфузии каждые 3 недели). В общей сложности 156 пациентов были рандомизированы для лечения 5-ФУ (800 мг. / м2 в день в виде непрерывной инфузии с 1-го по 5-й день каждые 3 недели) и цисплатина (80 мг / м2 в виде 2-часовой инфузии в 1-й день каждые 3 недели). Капецитабин в сочетании с цисплатином продемонстрировал свою не меньшую эффективность к 5-ФУ в комбинации с цисплатином с точки зрения выживаемости без прогрессирования в анализе по протоколу (ОР 0,81; 95% ДИ: 0,63–1,04). Медиана выживаемости без прогрессирования составила 5,6 месяца (капецитабин + цисплатин) по сравнению с 5,0 месяцами (5-ФУ + цисплатин). Отношение рисков для продолжительности выживания (общей выживаемости) было аналогично отношению рисков для выживаемости без прогрессирования (ОР 0,85; 95% ДИ: 0,64–1,13). Средняя продолжительность выживаемости составила 10,5 месяцев (капецитабин + цисплатин) по сравнению с 9,3 месяца (5-ФУ + цисплатин).
Данные многоцентрового рандомизированного клинического исследования фазы III, сравнивающего капецитабин с 5-ФУ, оксалиплатином и цисплатином у пациентов с распространенным раком желудка, поддерживают использование капецитабина в качестве первой линии лечения распространенного рака желудка (REAL-2). В исследовании 1002 пациента были рандомизированы по факторному плану 2x2 в одну из следующих 4 групп:
- ЭКФ: эпирубицин (50 мг / м2 болюсно в 1-й день каждые 3 недели), цисплатин (60 мг / м2 в виде 2-часовой инфузии в 1-й день каждые 3 недели) и 5-ФУ (200 мг / м2 ежедневно. по мере продолжения инфузии через центральный катетер).
- ЭКХ: эпирубицин (50 мг / м2 в виде болюса в 1 день каждые 3 недели), цисплатин (60 мг / м2 в виде 2-часовой инфузии в 1 день каждые 3 недели) и капецитабин (625 мг / м2 два раза в день в качестве лечения. непрерывный).
- EOF: эпирубицин (50 мг / м2 в виде болюса в 1-й день каждые 3 недели), оксалиплатин (130 мг / м2 в виде 2-часовой инфузии в 1-й день каждые 3 недели) и 5-FU (200 мг / м2, вводимый ежедневно. по мере продолжения инфузии через центральный катетер).
- EOX: эпирубицин (50 мг / м2 в виде болюса в 1 день каждые 3 недели), оксалиплатин (130 мг / м2 в виде 2-часовой инфузии в 1 день каждые 3 недели) и капецитабин (625 мг / м2 два раза в день в качестве лечения. непрерывный).
Первичный анализ эффективности в популяции согласно протоколу продемонстрировал не меньшую эффективность в отношении общей выживаемости для схем, содержащих капецитабин, по сравнению с схемами на основе 5-ФУ (HR 0,86; 95% ДИ: 0,8-0,0, 99) и для схем, содержащих оксалиплатин, по сравнению к схемам на основе цисплатина (ОР 0,92; 95% ДИ: 0,80 - 1,1). Медиана общей выживаемости составила 10,9 месяца при схемах, основанных на капецитабине, и 9,6 месяцев при схемах, содержащих 5-ФУ. Медиана общей выживаемости составила 10,0 месяцев при схемах на основе цисплатина и 10,4 месяца при схемах на основе оксалиплатина.
Капецитабин также использовался в комбинации с оксалиплатином для лечения запущенного рака желудка. Исследования только с капецитабином показывают, что капецитабин проявляет активность при распространенном раке желудка.
Распространенный рак желудка, толстой кишки и толстой кишки: метаанализ
Метаанализ шести клинических исследований (исследования SO14695, SO14796, M66001, NO16966, NO16967, M17032) поддерживает использование капецитабина в качестве замены только 5-ФУ и в комбинированном лечении рака желудочно-кишечного тракта. Объединенный анализ включает 3097 пациентов. лечились схемами, содержащими капецитабин, и 3074 пациентами, получавшими схемы, содержащие 5-ФУ. Средняя общая выживаемость составила 703 дня (95% ДИ: 671; 745) у пациентов, получавших схемы, содержащие капецитабин, и 683 дня (95% ДИ: 646; 715) у пациентов, получавших схемы, содержащие 5-ФУ. Отношение рисков для общей выживаемости составило 0,94 (95% ДИ: 0,89; 1,00, p = 0,0489), что указывает на то, что схемы, содержащие капецитабин, не уступают схемам, содержащим 5-ФУ.
Рак молочной железы
Комбинированная терапия капецитабином и доцетакселом при местнораспространенном или метастатическом раке молочной железы
Данные фазы III многоцентрового рандомизированного контролируемого клинического исследования подтверждают использование капецитабина в комбинации с доцетакселом для лечения пациентов с прогрессирующим местнораспространенным или метастатическим раком молочной железы после неэффективности цитотоксической химиотерапии, которая включала «антрациклин». В этом исследовании 255 пациентов были рандомизированы для лечения капецитабином (1250 мг / м2 два раза в день в течение 2 недель с последующим 1-недельным периодом отдыха и доцетакселом 75 мг / м2 в виде 1-часовой внутривенной инфузии каждые 3 недели). 256 пациентов были рандомизированы для лечения только доцетакселом (100 мг / м2 в виде 1-часовой внутривенной инфузии каждые 3 недели). Выживаемость была выше в группе комбинации капецитабин + доцетаксел (p = 0,0126). Средняя выживаемость составила 442 дня (капецитабин + доцетаксел) по сравнению с 352 днями (только доцетаксел). Общая частота объективных ответов во всей рандомизированной популяции (оценка исследователя) составляла: 41,6% (капецитабин + доцетаксел) по сравнению с 29,7% (только доцетаксел); p = 0,0058. Время до прогрессирования заболевания было выше в группе комбинации капецитабин + доцетаксел ( п
Монотерапия капецитабином после неэффективности таксановой и антрациклин-содержащей химиотерапии и когда антрациклиновая терапия не показана
Данные двух многоцентровых клинических исследований фазы II подтверждают использование монотерапии капецитабином для лечения пациентов, у которых прогрессирует неэффективность химиотерапии, включающей таксаны и антрациклин, или которым не показана дополнительная терапия. Антрациклины. В этих исследованиях всего 236 пациентов получали капецитабин (1250 мг / м2 два раза в день в течение 2 недель с последующей 1 неделей отдыха). Общая частота объективных ответов (оценка исследователя) составила 20% (первое исследование) и 25% (второе исследование). прогрессирование составило 93 и 98 дней. Медиана выживаемости составила 384 и 373 дня.
Все показания:
Метаанализ 14 клинических испытаний с данными более чем 4700 пациентов, получавших только капецитабин или в комбинации с различными режимами химиотерапии по нескольким показаниям (рак толстой кишки, толстой кишки, желудка и груди), показал более длительную общую выживаемость у пациентов, получавших капецитабин. синдром кисти-стопы, чем у пациентов, которые этого не сделали: средняя общая выживаемость 1100 дней (95% ДИ: 1007, 1200) против 691 дня (95% ДИ: 638; 754) с отношением рисков 0,61 (95% ДИ: 0,56). , 0,66).
Педиатрическая популяция:
Европейское агентство по лекарственным средствам освободило от обязанности проводить исследования с Кселодой во всех подклассах педиатрической популяции при аденокарциноме прямой и толстой кишки, аденокарциноме желудка и раке груди (информацию о «применении в педиатрии» см. В разделе 4.2).
05.2 Фармакокинетические свойства
Фармакокинетика капецитабина оценивалась в диапазоне доз 502-3514 мг / м2 / день. Параметры капецитабина, 5 "-деокси-5-фторцитидина (5" -DFCR) и 5 "-дезокси-5-фторуридина (5" DFUR), измеренные в дни 1 и 14, были аналогичными. AUC 5-FU на 14 день была на 30-35% выше.Снижение дозы капецитабина снижает системное воздействие 5-FU более дозозависимым образом из-за нелинейной фармакокинетики активного метаболита.
Абсорбция
После приема внутрь капецитабин полностью и быстро всасывается; впоследствии он полностью превращается в метаболиты 5 "-DFCR и 5" -DFUR. Прием с пищей снижает скорость абсорбции капецитабина, но оказывает лишь незначительное влияние на AUC 5 "-DFUR и AUC последующего метаболита 5-FU. В дозе 1250 мг / м2 на 14 день, вводимой после еды, максимальные концентрации в плазме (Cmax в мкг / мл) капецитабина, 5 "-DFCR, 5" -DFUR, 5-FU и FBAL составляли соответственно 4,67 - 3,05 - 12,1 - 0,95 и 5,46. Время достижения максимальных концентраций в плазме (Tmax в часах) составляла 1,50 - 2,00 - 2,00 - 2,00 и 3,34. Значения AUC0- ∞ в мкг • ч / мл составляли 7,75 - 7,24 - 24,6 - 2,03 и 36,3.
Распределение
Проведены исследования плазмы человека in vitro показали, что капецитабин, 5 "DFCR, 5" -DFUR и 5-FU связываются с белками, главным образом с альбумином, в процентах 54%, 10%, 62% и 10% соответственно.
Биотрансформация
Капецитабин сначала метаболизируется карбоксилэстеразой печени до 5 "-DFCR, который затем превращается в 5" -DFUR под действием цитидиндезаминазы, локализованной в основном в печени и опухолевых тканях. Затем происходит «дальнейшая каталитическая активация 5» -DFUR тимидинфосфорилазой (ThyPase). Ферменты, участвующие в каталитической активации, присутствуют в опухолевых тканях, но также и в здоровых тканях, хотя обычно в меньших количествах.Последовательная ферментативная биотрансформация капецитабина в 5-ФУ приводит к более высоким концентрациям в опухолевых тканях. При колоректальном раке генерация 5-ФУ, по-видимому, в значительной степени локализована в стромальных клетках опухоли. После перорального введения капецитабина пациентам с колоректальным раком отношение концентрации 5-ФУ при колоректальном раке к прилегающим тканям составляло 3,2 (в диапазоне от 0,9 до 8,0). Отношение концентрации 5-ФУ в опухоли к плазме составляло 21,4 (от 3,9 до 59,9, n = 8), тогда как отношение в здоровой ткани к плазме составляло 8,9 (с вариациями от 3,0 до 25,8, n = 8). Активность тимидинфосфорилазы была измерена и обнаружена в 4 раза выше при первичном колоректальном раке, чем сообщаемые значения в прилегающих нормальных тканях. На основании иммуногистохимических исследований, тимидинфосфорилаза, по-видимому, в значительной степени локализована в стромальных клетках опухоли.
5-ФУ впоследствии катаболизируется ферментом дигидропиримидиндегидрогеназой (DPD) в дигидро-5-фторурацил (FUH2), который является гораздо менее токсичным. Дигидропиримидаза действует на пиримидиновое кольцо с получением 5-фтор-уреидопропионовой кислоты (FUPA). Наконец, b -уреидопропионаза превращает FUPA в a-фтор-b-аланин (FBAL), который выводится с мочой. Активность дигидропиримидиндегидрогеназы (DPD) является критическим ограничивающим фактором. Дефицит DPD может вызвать «повышенную токсичность капецитабина» (см. Разделы 4.3 и 4.4).
Устранение
Период полувыведения (t½ в часах) капецитабина, 5 "-DFCR, 5" -DFUR, 5-FU и FBAL составлял 0,85 - 1,11 - 0,66 - 0,76 и 3, соответственно, 23. Капецитабин и его метаболиты выводятся в первую очередь. с мочой; 95,5% введенной дозы капецитабина выводилось с мочой. Выведение с фекалиями минимально (2,6%). Основным метаболитом, выделяемым с мочой, является FBLA, на долю которого приходится 57% введенной дозы. Примерно 3% введенной дозы выводится с мочой в неизмененном виде.
Ассоциативная терапия
Исследования фазы I, оценивающие влияние капецитабина на фармакокинетику доцетаксела или паклитаксела и наоборот, показали, что нет эффекта капецитабина на фармакокинетику доцетаксела или паклитаксела (Cmax и AUC) и что доцетаксел или паклитаксел не влияют на фармакокинетика 5 "-ДФУР.
Фармакокинетика в конкретных группах пациентов
Популяционный фармакокинетический анализ был проведен после лечения капецитабином в дозе 1250 мг / м2 два раза в день у 505 пациентов с колоректальным раком. Пол, наличие или отсутствие метастазов в печени на исходном уровне, статус производительности по Карновски, общий билирубин, сывороточный альбумин, ASAT и ALAT не оказывал статистически значимого влияния на фармакокинетику 5 "-DFUR, 5-FU и FBAL.
Пациенты с нарушением функции печени из-за метастазов в печень: Фармакокинетическое исследование показало, что биодоступность капецитабина и воздействие 5-ФУ могут быть увеличены у онкологических больных с легкой и умеренной печеночной недостаточностью из-за метастазов в печень по сравнению с пациентами без печеночной недостаточности.Доступность фармакокинетических данных у пациентов с тяжелой печеночной недостаточностью .
Пациенты с нарушением функции почекНа основании результатов фармакокинетического исследования, проведенного у онкологических больных с легкой и тяжелой почечной недостаточностью, нет никаких доказательств того, что клиренс креатинина влияет на фармакокинетику исходного лекарственного средства и 5-ФУ. Было обнаружено, что клиренс креатинина влияет на «системное воздействие 5» -DFUR (увеличение AUC на 35% при снижении клиренса креатинина на 50%) и FBAL (увеличение AUC на 114% при снижении клиренса креатинина на 50%) 50%). FBAL - это метаболит, не обладающий антипролиферативной активностью.
Пожилые граждане: На основании популяционного фармакокинетического анализа, проведенного на пациентах разного возраста (от 27 до 86 лет), из которых 234 (46%) пациентов были в возрасте 65 лет и старше, возраст не влияет на фармакокинетику 5 "-DFUR и 5-FU. . AUC FBAL увеличивается с возрастом (увеличение возраста на 20% приводит к увеличению AUC FBAL на 15%). Это увеличение, вероятно, связано с изменением функции почек.
Этнические факторы: После перорального приема капецитабина 825 мг / м2 два раза в день в течение 14 дней у японских пациентов (n = 18) Cmax примерно на 36% и AUC для капецитабина на 24% ниже по сравнению с пациентами европеоидной расы (n = 22). У японских пациентов Cmax примерно на 25% ниже и AUC для FBAL на 34% ниже, чем у пациентов европеоидной расы. Клиническая значимость этих различий неизвестна. Не было значительных различий в воздействии других метаболитов (5 "DFCR, 5" DFUR и 5-FU).
05.3 Доклинические данные по безопасности
В исследованиях токсичности повторных доз ежедневное введение капецитабина перорально макакам и мышам cynomolgus вызывало желудочно-кишечные, гемопоэтические и лимфатические токсические эффекты, типичные для фторпиримидинов. Эти токсические эффекты были обратимыми. Наблюдалась кожная токсичность, характеризующаяся дегенеративными / регрессивными изменениями, вызванная капецитабином. Капецитабин не проявлял токсичности для печени и ЦНС. Сердечно-сосудистая токсичность (например, удлинение интервала PR и интервала QT) была обнаружена у яванских макак после внутривенного введения (100 мг / кг), но не после повторного приема (1379 мг / м2 / день) перорально.
Двухлетнее исследование канцерогенности на мышах не дало никаких доказательств канцерогенности из-за капецитабина.
В стандартных исследованиях фертильности у самок мышей, принимавших капецитабин, наблюдались нарушения фертильности; однако этот эффект был обратимым после периода приостановки действия препарата. Кроме того, в течение 13-недельного исследования в репродуктивных органах мышей-самцов были обнаружены атрофические и дегенеративные изменения; однако эти эффекты были обратимы после периода отмены препарата (см. раздел 4.6).
Исследования эмбриотоксичности и тератогенности на мышах показали дозозависимое увеличение резорбции плода и тератогенности. У обезьян при высоких дозах наблюдались аборты и эмбриональная летальность, но не было доказательств тератогенности.
Капецитабин не обладает мутагенным действием. in vitro для бактерий (тест Эймса) или для клеток млекопитающих (тест мутации гена V79 / HPRT китайского хомяка). Однако, как и другие аналоги нуклеозидов (например, 5-ФУ), капецитабин оказался кластогенным в лимфоцитах человека (in vitro) и показал положительную динамику в тесте (in vivo) микроядер в костном мозге мыши.
06.0 ФАРМАЦЕВТИЧЕСКАЯ ИНФОРМАЦИЯ
06.1 Вспомогательные вещества
Ядро планшета:
безводная лактоза,
кроскармеллоза натрия,
гипромеллоза,
микрокристаллическая целлюлоза,
стеарат магния.
Покрытие таблеток:
гипромеллоза,
диоксид титана (E171),
желтый и красный оксид железа (E172),
тальк.
06.2 Несовместимость
Не имеет значения.
06.3 Срок действия
3 года.
06.4 Особые меры предосторожности при хранении
Не хранить при температуре выше 30 ° C.
06.5 Характер непосредственной упаковки и содержимого упаковки
Природа: блистер из ПВХ / ПВДХ.
В комплекте: 60 таблеток, покрытых пленочной оболочкой (6 блистеров по 10 таблеток).
06.6 Инструкции по эксплуатации и обращению
Никаких особых инструкций.
07.0 ДЕРЖАТЕЛЬ РАЗРЕШЕНИЯ НА МАРКЕТИНГ
Roche Registration Limited
6 Соколиный путь
Shire Park
Welwyn Garden City
AL7 1TW
Соединенное Королевство
08.0 НОМЕР РАЗРЕШЕНИЯ НА МАРКЕТИНГ
EU / 1/00/163/001
035219017
09.0 ДАТА ПЕРВОГО РАЗРЕШЕНИЯ ИЛИ ПРОДЛЕНИЯ РАЗРЕШЕНИЯ
Дата первого разрешения: 2 февраля 2001 г.
Дата последнего обновления: 2 февраля 2006 г.
10.0 ДАТА ПЕРЕСМОТРА ТЕКСТА
Сентябрь 2015 г.